El hierro es un metal alotrópico. Cambia su estructura cristalina dependiendo de la temperatura a la que se encuentre. Esta característica la vamos a aprovechar para poder realizar los tratamientos térmicos y modificar las propiedades mecánicas de los aceros.
Conociendo sus estructuras dominaremos los tratamientos térmicos del acero.
CON EL MICROSCOPIO:
Si tomamos una muestra de una barra de hierro, la pulimos y la atacamos con un reactivo como el Nital (Acido Nítrico + alcohol) para crear un contraste que nos permita ver por el microscopio óptico de 100 aumentos, podemos ver que el hierro puro a temperatura ambiente está formado “células” denominadas granos.
 Fig. 1.- Representación de micrografía a 100 aumentos del Hierro puro a temperatura ambiente.
Fig. 1.- Representación de micrografía a 100 aumentos del Hierro puro a temperatura ambiente.
En algunos casos podríamos ver estos granos hasta a simple vista. Estos granos se juntan en el denominado límite de grano. El tamaño medio de un grano de ferrita puede ser de 125 µm (micras o micrómetro). 1 µm corresponde a 0.001 milímetro o 1 milésima de milÍmetro. Como referencia el diámetro de un pelo puede ser de unas 50 micras.
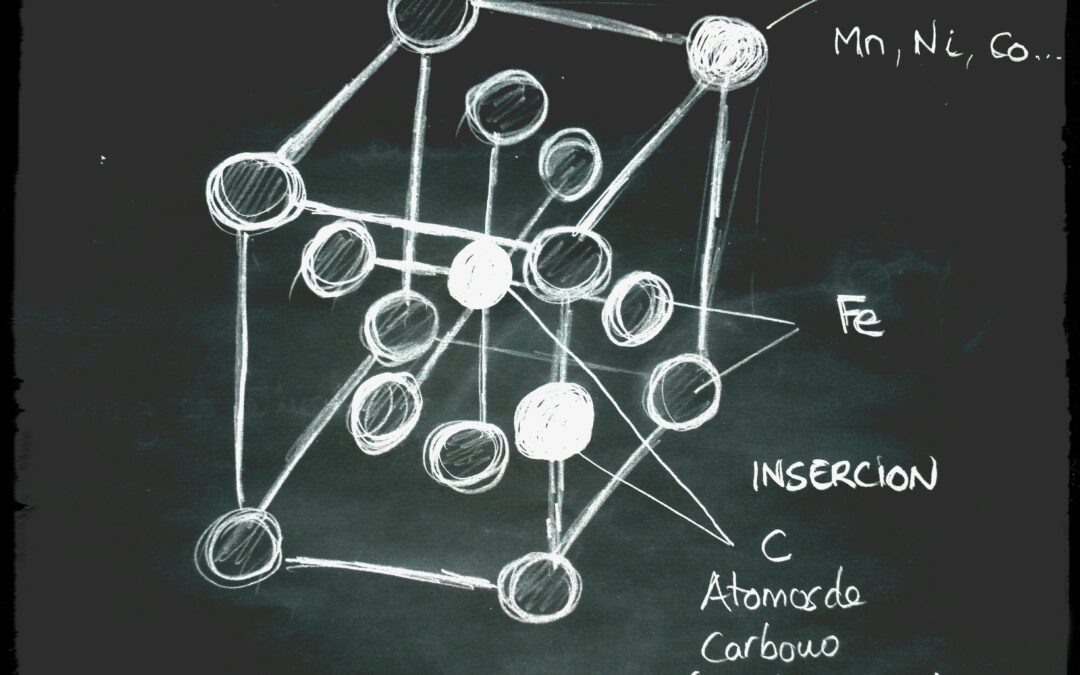
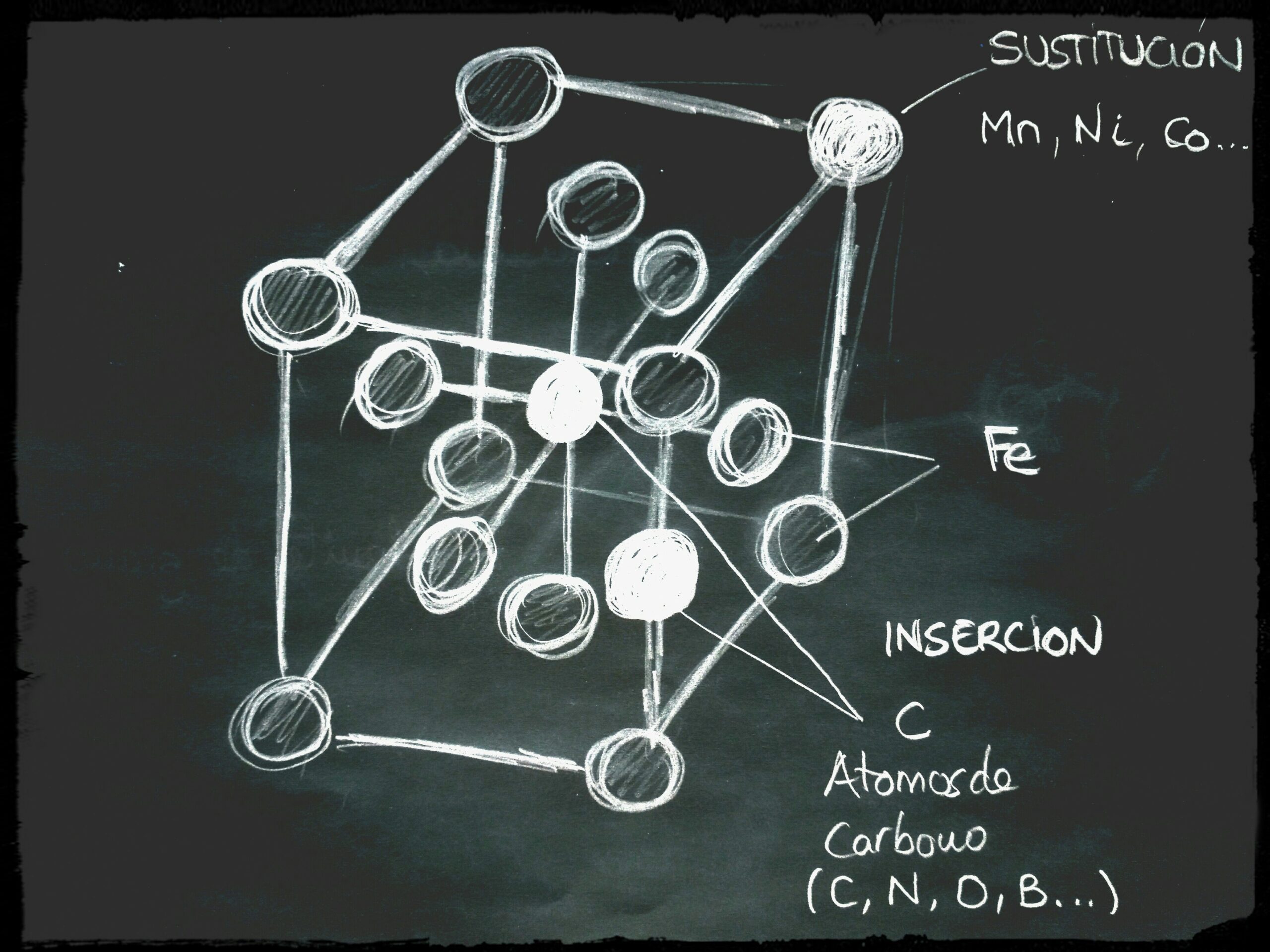
Mediante técnicas avanzadas podemos ver que cada uno de los granos están integrados por un conjunto de celdas elementales que forman cristales en forma de cubos con átomos de hierro (Fe) compartidos en cada esquina de celda elemental y uno de ellos en el centro del cubo.
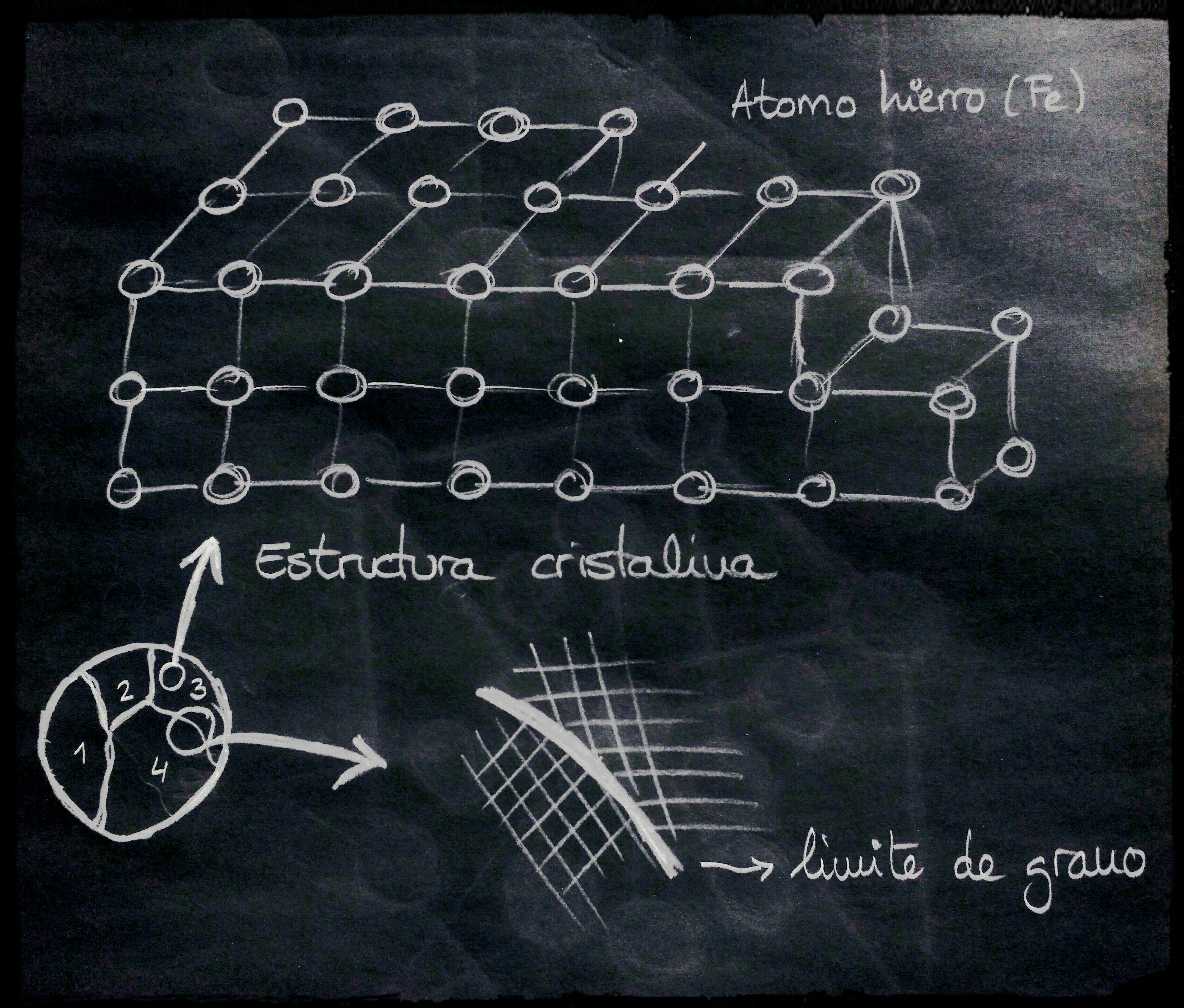 Fig. 2.- Estructura cristalina del hierro y límite de grano.
Fig. 2.- Estructura cristalina del hierro y límite de grano.
FORMAS ALOTROPICAS DEL HIERRO:
Cuando el hierro puro a 1538ºC comienza a solificar los átomos de hierro se ordenan por sí solos mediante mecanismos de nucleación y crecimiento, formando una estructura cristalina (hierro delta) en grupos que en un momento dado se encuentran con un grupo vecino, definiendo el límite de grano. Por debajo de los 1388ºC hay una transformación de estos cristales al hierro gamma. De nuevo al bajar la temperatura por debajo de los 912ºC, el hierro modifica su estructura cristalina formando de nuevo una estructura cristalina denominada hierro alfa. Estos cristales son demasiados pequeños para poder ser observados con un microscopio ordinario, pero sí que en algunos casos podemos ver los granos a simple vista.
Dependiendo de los huecos y las distancias entre los átomos de hierro, posibilitará la inserción y solución de los átomos de carbono.
HIERRO ALFA (α) (hasta los 911ºC)
El hierro puro a temperatura ambiente está formado por hierro alfa, con una estructura cristalina cúbica centrada en el cuerpo ( 1/8 de atomo en cada esquina y uno en el centro del cubo) en total 2 átomos de hierro en cada celda.
 Fig. 3.- Estructura cristalina CUBICA CENTRADA EN EL CUERPO del Hierro puro a temperatura ambiente.
Fig. 3.- Estructura cristalina CUBICA CENTRADA EN EL CUERPO del Hierro puro a temperatura ambiente.
La solubilidad del carbono en la estructura cúbica centrada en el cuerpo es casi nula a temperatura ambiente. El carbono apenas se disuelve en el hierro alfa (como el azúcar en el café muy frío), solubilizando apenas un 0.09% de carbono a 727ºC. Por debajo de esta temperatura, el contenido de carbono que solubiliza el hierro alfa disminuye hasta llegar a ser casi nulo: 20ppm (partes por millón). Cuando el hierro alfa contiene carbono, por poco que sea, se le denomina FERRITA.
HIERRO GAMMA (γ) (912º-1388ºC):
Por encima de los 912ºC el hierro sufre una transformación alotrópica, cambiando su estructura a cúbica centrada en las caras (1/8 de átomo en cada esquina y 1/2 en cada cara), con un total de 4 átomos de hierro en cada celda. Teniendo un mayor tamaño que la estructura formada por el hierro alfa. De ésta forma el carbono si que solubiliza en el hierro gamma hasta un máximo de 2.11% de carbono que es su límite de saturación. Este cambio de estructura cristalina que si solubiliza el carbono, lo vamos a aprovechar para modificar las propiedades mecánicas en el templado del acero. Convirtiendo un material blando en uno duro y frágil.

Fig. 4.- Estructura cristalina CUBICA CENTRADA EN LAS CARAS del Hierro puro a temperaturas entre 912-1388ºC
HIERRO DELTA (δ) (desde 1388ºC hasta su fusión):
A 1388ºC sufre de nuevo una transformación alotrópica, formando una estructura cristalina cúbica centrada en el cuerpo, con 2 átomos de hierro en cada celda.

Fig. 5.- Estructura cristalina CUBICA CENTRADA EN EL CUERPO del Hierro Delta a temperaturas de entr 1388ºC hasta su fusión.
A 1538ºC el hierro puro se funde.


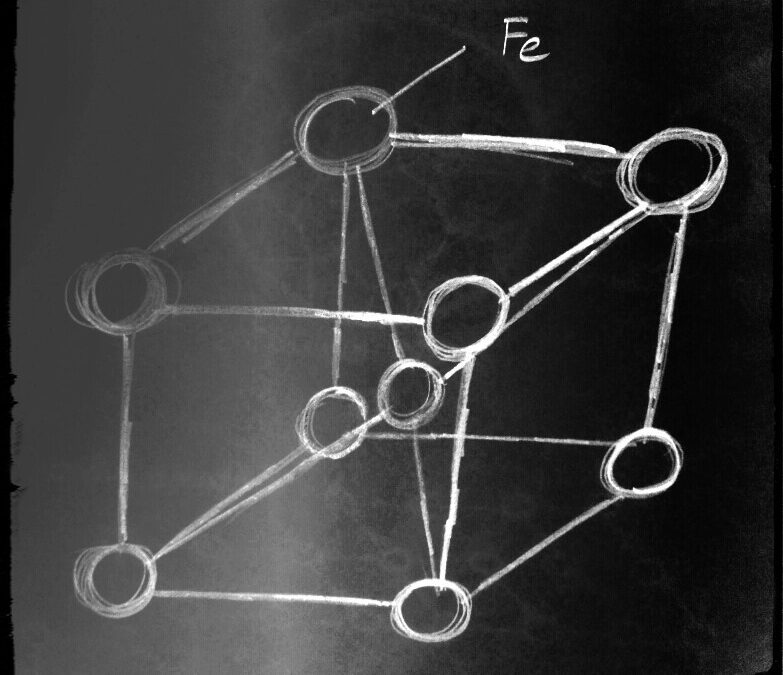
 Fig. 1.- Representación de micrografía a 100 aumentos del Hierro puro a temperatura ambiente.
Fig. 1.- Representación de micrografía a 100 aumentos del Hierro puro a temperatura ambiente. Fig. 2.- Estructura cristalina del hierro y límite de grano.
Fig. 2.- Estructura cristalina del hierro y límite de grano. Fig. 3.- Estructura cristalina CUBICA CENTRADA EN EL CUERPO del Hierro puro a temperatura ambiente.
Fig. 3.- Estructura cristalina CUBICA CENTRADA EN EL CUERPO del Hierro puro a temperatura ambiente.